Human CHN1 Mutations Hyperactivate α2Chimaerin and Cause Duane’ s Retraction SyndromeNoriko Miyake,
Wai-Man Chan, James Allen, John Chilton, Krystal Law, Maria Psatha, Moira Crosier, Nick J. Gutowski, Binoy Appukuttan, Alfonso Baldi, Mustafa Sahin, Sian Ellard, J. Timothy Stout, Mara Campioni, Sarah Guthrie, Long Cheng,
Susan Lindsay, Caroline Andrews, Michelle Cheung, Elizabeth Young, Stephen Christiansen, Juan C. Zenteno, Elizabeth C. Engle  Alessandro Iannaccone, Maria Laura Ciccarelli, Dominic Davenport, Laura E. Mariani Alessandro Iannaccone, Maria Laura Ciccarelli, Dominic Davenport, Laura E. MarianiSCIENCE VOL 321, P.839-843, 8 AUGUST 2008 .
|
|
|
Duane ’s retraction syndrome (DRS) является сложным врожденным нарушением движений глаз, вызываемым аберрантной иннервацией мышц глазного яблока аксонами моторных нейронов ствола мозга. Изучение семей с вариантной формой нарушения (DURS2-DRS), были идентифицировны причинные гетерозиготные миссенс мутации в CHN1 , гене на хромосоме 2q31, который кодирует α2-chimaerin, сигнальный белок Rac guanosine triphosphatase –activating protein (RacGAP) , ранее описан, как участвующий в нахождении путей кортикоспинальными аквонами у мышей. Было установлено, что существуют мутации с избыточной функией, которые увеличивают активность α 2chimaerin RacGAP in vitro . Некоторые из мутаций, по-видимому, усиливают транслокацию α 2chimaerin в клеточные мембраны или усиливают его способрность к само-ассоциации. Экспрессия мутантной α 2chimaerin конструкции у эмбрионов кур приводи к неспособности oculomotor аксонов иннервировать свои мишени в мышцах глазного яблока.
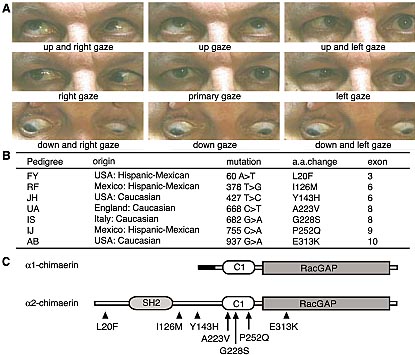 Fig. 1. Duane ’s retraction syndrome (DRS) and corre- sponding CHN1 mutations. ( A) Affected mem ber of p ed igree JH with limited outward gaze (abdu ction) and narrowing of the palpebral fissure on attempted inw ard gaze (adduction) most obvious on leftward gaze. He also has bilateral exotropia on downgaze. (B) The seven DURS2-DRS pedigrees and corresponding heterozygous CHN1 mutations. (C) Schematic representation of a1-chimaerin (top, 334 amino acids) and α 2chimaerin (bottom, 45 9 amino acids) protein. The isoforms contain identical C1 and RacGAP domains; only
a 2-chimaerin c onta ins a n SH2 domain. M utations a lter residues unique to α 2chimaerin or common to both proteins, as indicated by the arrows. No mutations were found in the a1-chimaerin N-terminal s equence ( highlighted in black).
Fig. 1. Duane ’s retraction syndrome (DRS) and corre- sponding CHN1 mutations. ( A) Affected mem ber of p ed igree JH with limited outward gaze (abdu ction) and narrowing of the palpebral fissure on attempted inw ard gaze (adduction) most obvious on leftward gaze. He also has bilateral exotropia on downgaze. (B) The seven DURS2-DRS pedigrees and corresponding heterozygous CHN1 mutations. (C) Schematic representation of a1-chimaerin (top, 334 amino acids) and α 2chimaerin (bottom, 45 9 amino acids) protein. The isoforms contain identical C1 and RacGAP domains; only
a 2-chimaerin c onta ins a n SH2 domain. M utations a lter residues unique to α 2chimaerin or common to both proteins, as indicated by the arrows. No mutations were found in the a1-chimaerin N-terminal s equence ( highlighted in black).
|